Catégorie : Actualités vétérinaires
Par Dre Valérie Sauvé, DMV, Dipl. ACVECC
Le printemps est arrivé et nous sommes tous, incluant nos compagnons poilus, très excités d’aller jouer dehors! Cependant, il faut garder en tête que la chaleur, surtout couplée avec la surexcitation, l’humidité ou l’exercice, peut présenter des dangers pour nos amis canins.
Notre discussion ici portera principalement sur les chiens, parce qu’il est rare que les chats souffrent de coups de chaleur. Nous ne voyons que quelques chats chaque année à l’urgence qui sont très malades d’avoir passé du temps dans une sécheuse en fonction, ou confinés au soleil direct.
Mais pourquoi ce chien, cette année et aujourd’hui?
D’abord, il est important de ne JAMAIS laisser un chien, un chat, un oiseau… ni son enfant seul dans la voiture l’été. C’est simple : il s’agit d’une règle ferme !
Ensuite, certains chiens auront une diminution de leur capacité ventilatoire de par leur conformation (p. ex. races brachycéphales) ou une maladie qui était peu clinique avant le stress de la chaleur. Pour ces patients, les marches devraient être évitées durant les journées chaudes et humides. Ils ne supporteront pas les halètements excessifs et préfèreront l’air conditionné.
En effet, particulièrement lorsqu’il fait chaud, les chiens dissipent la chaleur en haletant. Les chiens qui ont les voies respiratoires supérieures partiellement obstruées auront de la difficulté à évaporer la chaleur, ce qui causera plus de stress sur le système respiratoire. Cela peut causer de l’inflammation et de l’enflure, ce qui peut rendre la respiration et l’évacuation de la chaleur encore plus difficile. Ceci entraînera un cercle vicieux de difficulté respiratoire, d’anxiété et d’hyperthermie pouvant les mener directement à l’urgence. Par exemple, il est courant que des chiens avec de légers symptômes de paralysie laryngée ou collapse trachéal nous soient amenés en détresse respiratoire et hyperthermie sévère au printemps.
Les animaux plus vieux ou ceux avec des conditions médicales seront aussi plus sensibles aux variations de température.
L’acclimatisation fait toute la différence
Il est préférable de garder le jogging ou les jeux de frisbee pour les journées plus fraîches, les soirées ou tôt le matin, pour tous les chiens. Au début de l’été, recommandez d’augmentation de façon progressive l’exercice des chiens actifs en au moins 2 semaines lorsque les jours chauds arrivent.
Malgré la prévention, des clients nous appellent et suspectent un coup de chaleur – que recommander?
D’abord, il faut cesser toute activité physique, retirer l’animal de l’environnement chaud, le calmer et le placer dans un endroit ombragé et frais. Le propriétaire peut offrir de l’eau au chien s’il n’est pas en détresse respiratoire, est bien éveillé et ne démontre pas de vomissements. Ensuite, il est idéal de mesurer la température rectale, ceci sera utile afin de déterminer les prochaines actions à suivre. En général, il sera approprié de recommander de refroidir le chien, ne pas le submerger, mais plutôt le doucher (avec un tuyau d’arrosage par exemple) avec de l’eau légèrement froide. Ensuite, un ventilateur peut être appliqué sur l’animal.
Un bain de glace est déconseillé, en plus de possiblement noyer l’animal, ceci va ralentir la dissipation de la chaleur en causant la constriction des vaisseaux de la peau. Asperger d’alcool à friction est également déconseillé.
Traitement du coup de chaleur
L’animal devrait être évalué par un vétérinaire le plus tôt possible. À la présentation, la température peut être
élevée, normale ou basse selon les interventions du propriétaire et le délai de présentation. De façon générale, il est recommander de refroidir l’animal jusqu’à environ 39,5oC, puis de sécher le patient avec une serviette. Il n’est pas nécessaire de refroidir jusqu’à une température normale, puisque ceci entrainera souvent de l’hypothermie par la suite. L’hospitalisation sera recommandée dans la majorité des cas.
Une myriade de complications médicales peut se produire à la suite d’une hyperthermie marquée, tous les organes et tissus seront affectés par la chaleur. Le choc cardiovasculaire est une inquiétude primaire et se produit rapidement après l’exposition à la chaleur. Souvent, les patients seront présentés en choc hypovolémique et des fluides intraveineux en bolus seront requis. Les bolus de cristalloïdes seront administrés jusqu’à concurrence de 90 ml/kg (60 ml/kg chez le chat) par aliquote d’environ le quart de cette dose totale (20-30 ml/kg (10-15 ml/kg chat) en 15-20 minutes, répétés au besoin jusqu’à 90 ml/kg.) Si de larges volumes de fluides sont nécessaires, considérez utiliser des colloïdes après 2 ou 3 bolus de cristalloïdes (bolus de 5 ml/kg (3 ml/kg chat), jusqu’à un maximum de 20 ml/kg (15 ml/kg chat). Selon les pertes continues du patient, notez que ces volumes sont additifs, c’est-à-dire que donner ½ du volume total de cristalloïdes (45 ml/kg) puis ½ de colloïdes (10 ml/kg) constitue la quantité maximale de fluides appropriée à administrer. Des inopresseurs (norépinéphrine, dopamine, etc.) pourraient s’avérer nécessaires si le patient ne se stabilise pas avec des fluides seulement.
La coagulation intravasculaire disséminée est une séquelle commune du coup de chaleur et peut se développer jusqu’à plusieurs heures après le retour à la normale de la température. Idéalement, un comptage plaquettaire et un profil de coagulation (PT/PTT ) devraient être faits à la présentation et plus tard en court de traitement selon la progression. Une transfusion de plasma est souvent nécessaire pour corriger les anomalies de l’hémostase secondaire.
De l’oxygène devait être administré à la présentation et jusqu’à ce qu’il soit déterminé que le patient a une bonne oxygénation artérielle. Un oxymètre de pouls ou un gaz sanguin artériel aidera à évaluer de façon objective le besoin de supplémentation d’O2. Des radiographies thoraciques sont indiquées dans plusieurs cas, considérant que de l’hémorragie pulmonaire et une pneumonie par aspiration peuvent se développer. Un examen des voies respiratoires supérieures peut aussi être indiqué lorsque l’animal sera stable.
Le système nerveux central sera affecté à divers degré, ceci manifesté pas un état mental altéré jusqu’à des convulsions ou un coma dans les cas graves. L’hypoglycémie peut contribuer à un état mental altéré et devrait être suivie et traitée tôt. Une fois la perfusion rétablie, l’état mental de l’animal devrait être réévalué et du mannitol peut être administré au besoin (0.5 à 1 G/kg en 20 minutes) ainsi que les soins de support et symptomatiques.
Enfin, les reins et le système digestif peuvent aussi être touchés. Il sera important de surveiller la production urinaire, les valeurs rénales et les électrolytes et de fournir des traitements de support pour les symptômes digestifs.
Pronostic
Selon le degré et la durée de l’hyperthermie et l’intervention médicale rapide et efficace, beaucoup survivront cette condition sans séquelle significative. Malheureusement, si plusieurs systèmes sont gravement touchés, particulièrement si le système nerveux central est sévèrement affecté, et selon la condition de santé préalable de l’animal, le coup de chaleur peut aussi s’avérer mortel.
Cela se produit en général au début de l’été, avant que les animaux se soient acclimatés aux chaleurs, alors soyez prêts !
Pour télécharger et imprimer cet article, cliquez ici.
À compter du 10 septembre, le DMV pourra compter trois jours par semaine sur une spécialiste additionnelle au service d’imagerie médicale, Dre Kate Alexander, DMV, radiologiste diplômée de l’American College of Veterinary Radiology (DACVR). L’arrivée de cette spécialiste réputée nous permettra de mieux desservir les centres de proximité, DMV-Sud et DMV-Nord et d’étendre notre service d’interprétation de radiographies pour les établissements vétérinaires. Elle se joint aux deux autres spécialistes en imagerie médicale du DMV, Dre Julie Gadbois et Dr Hugo Joly.
Dre Kate Alexander a reçu son diplôme DMV de la Faculté de médecine vétérinaire de l’Université de Montréal en 1998. Elle a ensuite effectué un internat en médecine et chirurgie des grands animaux à l’OVC, à Guelph. Après un passage en pratique ambulatoire équine en Oregon, elle a complété son internat en imagerie vétérinaire en 2004, à l’université Ohio State.
En 2004, elle est devenue professeure à la FMV, où elle a joué un rôle très actif dans la recherche et auprès des étudiants. La qualité de son enseignement a été reconnue par des prix d’excellence. Elle est actuellement examinatrice pour l’American College of Veterinary Radiology.
Article rédigé par Dr Jérôme D’Astous, DMV, Dipl. AVDC, et publié dans le Focus DMV du 29 mai 2014
La dentisterie serait beaucoup plus simple si on pouvait laisser tous les bouts de racines en place. Malheureusement, ce n’est pas le cas. Mais cela ne veut pas dire qu’on ne peut jamais le faire.
Examinons une situation où vous avez fracturé une racine durant son extraction. Il faut tout d’abord vous demander si cela aurait pu être évité. Votre radiographie préopératoire, l’inspection du fragment cassé et de l’alvéole vous donneront souvent la réponse et vous aideront à ne pas répéter la même erreur. Profitez-en pour apprendre de celle-ci.
Sur une radiographie préopératoire, je recherche les formes anormales (dilacérations), l’ankylose donto-alvéolaire, les racines surnuméraires, la résorption dentaire… J’évalue aussi la proximité des structures adjacentes, que ce soit une autre dent, le canal mandibulaire, la cavité nasale ainsi que l’intégrité de l’os à proximité.
Bien planifier une extraction prend quelques secondes et peut vous épargner bien des maux de tête : il suffit d’une ou plusieurs radiographies dentaires.
Sans entrer dans les détails, il ne faut pas non plus tomber dans le piège de tenter une extraction simple alors qu’une extraction chirurgicale est de mise. Connaissez vos techniques d’extraction et aussi vos limites. Cela ne veut pas dire qu’on ne peut pas les repousser un jour. Soyez aussi bien équipés !
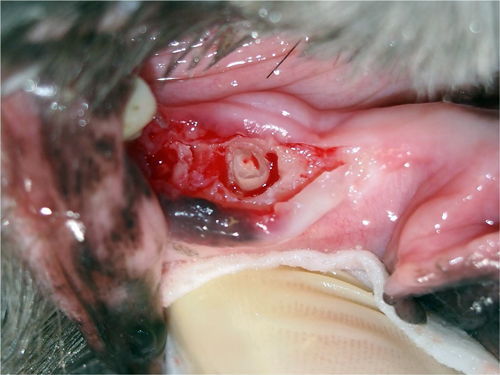
Malgré tout votre bon vouloir, des racines cassées, il va y en avoir ! Voici l’approche que je vous conseille si cela arrive :
- Premièrement, il ne faut pas paniquer. Prenez une bonne inspiration !
- Puis, il faut le voir pour le croire ! Si vous voyez ce que vous faites, tout est possible ou presque. Je parle donc ici de bien voir le fragment de racine retenue. N’hésitez pas à modifier la position du patient ou à demander de l’assistance pour de la rétraction. Ajustez votre lumière pour bien voir dans l’alvéole. L’idéal, ici, est une lumière frontale DEL qui suit en tout temps votre regard et évite les ombrages. Des loupes chirurgicales sont aussi un outil qui vous deviendra vite indispensable. Je recommande un modèle avec une puissance entre 2 et 3.5 de grossissement. Rincez l’alvéole abondamment avec de la saline pour retirer les débris et le sang accumulé. Certains vont aimer travailler avec une petite succion. Je préfère simplement une gaze que j’insère à répétition et au besoin dans l’alvéole. Si un saignement est plus abondant ou persiste, je vais paqueter l’alvéole légèrement avec une gaze et faire autre chose pendant 3 à 5 minutes. On peut aussi rincer avec de la saline plus froide pour avoir une vasoconstriction. Je n’ai jamais eu recours personnellement à des liquides ou matériels hémostatiques. Un peu de patience et c’est tout. N’hésitez pas à faire ou agrandir votre lambeau comme vous pouvez également commencer ou prolonger votre alvéolectomie. Pour finir ce point, pensez à reprendre une radiographie pour vous orienter. Elle peut encore une fois vous épargner du temps contrairement à ce qu’on pourrait penser.
- On devrait considérer une technique d’extraction simple lorsque la forme et la longueur du fragment sont en notre faveur, lorsque celui-ci est peu profond dans l’alvéole ou lorsqu’il a déjà été mobilisé durant l’extraction préalable. Mes instruments de choix sont un élévateur à ailettes de taille adéquate, un petit élévateur à apex (root tip pick) ou un mini luxateur. De petites pinces à apex sont parfois aussi utiles.
- Si une technique d’extraction simple ne fonctionne pas, il vaut mieux rapidement changer pour une technique complexe ou chirurgicale. Celle-ci nécessite habituellement un lambeau et au besoin une alvéolectomie. On peut évidemment débuter par cette technique lors d’ankylose donto-alvéolaire, hypercémentose, résorption dentaire… ou lorsque la visibilité du fragment est inadéquate. L’alvéolectomie se fait habituellement du côté buccal ou autour du fragment, en prenant garde de ne pas endommager les structures voisines. J’utilise le plus souvent une fraise #700 d’une longueur chirurgicale.
Quand doit-on enlever les fragments ? En général, sauf contre-indication, on devrait les retirer. On ne devrait pas laisser un fragment de racine si celui-ci est infecté ou si on croit qu’il pourrait s’infecter. On devrait aussi retirer un fragment s’il est gros ou s’il a déjà été mobilisé par la tentative initiale d’extraction. Il faut aussi le retirer s’il risque d’engendrer d’autres problèmes telle une malocclusion.
Quand peut-on laisser un fragment en place ?
Voici maintenant, ce que vous attendiez tous, quatre arguments pour laisser un fragment en place :
- Le fragment est petit (moins de 4-5 mm)
- Le fragment est situé profondément et ne risque pas de s’exposer dans la cavité orale
- Le fragment est bien ancré dans l’os, ankylosé ou en voie de résorption
- Le fragment n’est pas infecté et n’a pas de lésion apicale non plus
Si ces quatre conditions sont remplies, on peut considérer laisser un fragment en place, si, bien sûr, les risques de l’enlever sont plus grands que les bénéfices attendus. Pensez-vous devoir retirer une quantité excessive d’os pour atteindre le fragment ? Un nerf risque-t-il d’être endommagé ? Y a-t-il un risque de pousser le fragment dans un autre espace, comme la cavité nasale ou le canal mandibulaire ?
Si vous choisissez de laisser un fragment en place, ça ne s’arrête pas là ! Le client doit être avisé de votre décision et le tout doit être bien inscrit au dossier, incluant votre discussion avec ce dernier. Une radiographie dentaire doit aussi documenter la présence du fragment. Finalement, on devrait aussi assurer un suivi. Le suivi devrait inclure une radiographie dentaire, mais l’intervalle pour la faire variera selon votre appréciation du risque. On peut refaire une radiographie un mois plus tard ou simplement lors des prochains soins dentaires.
Sur ce, bon succès !
Pour télécharger l’article, cliquez ici.
Article rédigé par Dre Julie Gadbois, Dipl.ACVR, spécialiste de l’imagerie médicale
Pour télécharger cet article, sous forme de PDF, cliquez ici.
En médecine vétérinaire, la radiographie est au cœur des outils diagnostiques que nous utilisons tous les jours. La radioprotection demeure malheureusement un sujet banalisé et peu abordé au quotidien. Bien qu’invisibles et d’apparence bénigne, les rayons X ne sont pas sans effet délétère. Chaque semaine, nous voyons des corps étrangers humains sur les radiographies de vos patients : eh oui, des doigts ! Cela nous permet de constater que plusieurs sous-estiment les risques associés à une exposition chronique.
L’objectif de cet article est donc de revenir brièvement sur les concepts de base afin de vous donner des outils de discussion et de prévention dans votre pratique quotidienne.
Les effets nuisibles des rayons X
Plusieurs articles mentionnent l’effet potentiel sur l’ADN d’une exposition chronique à de faibles doses de radiation, et ultimement du développement possible de cancers. Le mécanisme exact demeure encore inconnu, mais l’association entre l’exposition aux radiations et la carcinogenèse demeure indiscutable. Comme le développement de cancer est souvent multifactoriel, il est difficile, voire impossible, de déterminer la dose minimale nécessaire au développement d’un cancer. Toute radiation doit donc être considérée comme potentiellement nuisible, peu importe la dose. Par conséquent, il est de mise d’appliquer le principe « ALARA », l’acronyme pour « As Low As Reasonably Achievable », c’est-à-dire de diminuer aussi bas qu’il est raisonnablement possible l’exposition aux rayons X.
Comment minimiser les risques
1 Limiter l’accès à la salle de radiographie
Bien que simple, cette mesure est parfois négligée. Il est recommandé de réduire au minimum le nombre de personnes dans la salle. Seules les personnes dont la présence est indispensable devraient être présentes. Idéalement, afin de réduire l’exposition annuelle de chacun des membres de votre équipe, tentez de faire une rotation des personnes qui font les radiographies. Toutes les portes menant à la salle de radiographie devraient être fermées durant l’examen.
2 Contention mécanique ou sédation
Selon les recommandations du gouvernement, on devrait placer le patient sous sédatif ou avoir recours à des appareils de contention (ex. sacs de sable) pendant l’examen radiographique. Si vous n’êtes pas à l’aise de laisser un de vos patients seul dans la salle pendant l’exposition, la sédation et l’emploi de moyens mécaniques de contention pourraient vous permettre de réduire au minimum le nombre de personnes nécessaires à la réalisation de ces radiographies.
3 Vêtements de protection (tablier, protège-glande thyroïde et gants plombés)
Il devrait être obligatoire pour tous de porter ces trois articles lors de la prise de radiographies. Ces vêtements devraient assurer une atténuation équivalant à au moins 0,5 mm de plomb pour des tensions pouvant atteindre 150 kVp. Plusieurs vous diront que les gants causent une mauvaise dextérité et empêchent parfois une bonne contention du patient. Si un patient ne peut être tenu de façon sécuritaire avec ces gants, une sédation devrait être considérée.
Il faut aussi préciser que ces équipements sont conçus pour protéger des rayons X secondaires (ceux ayant été déviés en périphérie de la radiographie) et non pas des rayons provenant du faisceau principal. Il est donc primordial de mettre l’accent sur le fait qu’il ne faut absolument pas que les mains ou toute autre partie du corps soient dans la région radiographiées, et ce, même avec des gants.
Les tabliers de protection, les gants et les protège-glandes thyroïdes doivent être entreposés et conservés conformément aux recommandations du fabricant (ex. : ils ne devraient pas être pliés). Il est également recommandé de vérifier par radiographie tous les vêtements et dispositifs de protection une fois par an ou lorsqu’un défaut est soupçonné.
4 Collimation et filtration
Une collimation serrée sur la région d’intérêt permet de diminuer la radiation secondaire tant au patient qu’au personnel dans la pièce. De plus, cela aide grandement à la résolution et à la qualité de la radiographie. Assurez-vous aussi qu’un filtre d’aluminium d’une épaisseur adéquate (aussi connu sous le nom de « couche de demi-atténuation) est présent entre la fenêtre du tube et le collimateur. Cela permet d’éliminer les rayons X de faible énergie. Sans ce type de filtre, l’exposition du patient et du personnel pourrait être augmentée inutilement de 4 fois la dose.
5 Toujours utiliser le temps d’exposition le plus court et réduire les reprises inutiles
En utilisant le temps d’exposition le plus court possible, cela réduit par le fait même les artéfacts dus au mouvement. L’emploi d’une charte technique et une bonne planification des radiographies permettent d’optimiser chacun des examens tout en réduisant le nombre de reprises inutiles.
6 Distance
Afin de minimiser les risques, il est recommandé de se tenir le plus loin possible du patient et de la source de rayons X. En aucun temps, une personne ne devrait s’asseoir ou s’appuyer sur la table de radiographie (en raison des radiations secondaires émises), optant plutôt pour une position debout à chaque extrémité de la table. Idéalement, il faudrait aussi éviter de regarder en direction du faisceau principal de radiographie.
Par ailleurs, il faut toujours s’assurer que toutes les personnes exposées dans le cadre de leurs fonctions professionnelles portent des dosimètres individuels pendant les examens radiographiques.
Pour plus d’informations sur le sujet, vous pouvez consulter :
– le document des « Normes minimales d’exercice » de l’Ordre des médecins vétérinaires du Québec;
– le document « Radioprotection en médecine vétérinaire — mesures de sécurité recommandées relativement à l’installation et à l’utilisation d’appareils à rayons x en médecine vétérinaire — Code de sécurité 28 » disponible sur le site internet de Santé Canada;
– le livre « Radiography in Veterinary Technology », écrit par Lisa M. Lavin.
Pour télécharger cet article, sous forme de PDF, cliquez ici.
Pour télécharger et imprimer cette affiche, cliquez ici.
Pour télécharger et imprimer cette affiche, cliquez ici.
Un article de Dre Lyanne Fyfle, DMV, Dipl. ACVIM (Médecine interne)
Je vous présente Cornichon, une chatte stérilisée domestique de 5 ans qui a consulté au centre DMV au département de médecine interne pour une toux chronique rapportée depuis au moins 1 an, mais accentuée dans le dernier mois.
Examen et tests
À l’examen physique, on note la présence d’efforts expiratoires, ainsi qu’une tachypnée légère. Cornichon souffre d’embonpoint important, ce qui semble exacerber sa condition respiratoire, mais empêche aussi la réalisation d’une bonne auscultation cardio-respiratoire. Aucune anomalie significative n’a été notée lors de l’auscultation thoracique. Des radiographies thoraciques récentes sont disponibles pour interprétation. Une pathologie bronchique modérée généralisée est visualisée et la silhouette cardiaque suggère la possibilité d’une légère cardiomégalie.
Un bilan sanguin complet avec une T4 totale est sans anomalie significative. Sa pression sanguine se situe dans des valeurs considérées normales pour un chat en clinique vétérinaire. Un dosage des anticorps contre Dirofilaria immitis a été effectué : son résultat est positif. Ce chat souffre-t-il d’une infection aux vers du cœur ?
Troubles respiratoires
Chez le chat, les infections à D.immitis peuvent être asymptomatiques ou certains chats peuvent manifester des signes cliniques plutôt vagues. Autrement, le portrait clinique d’une infection féline aux vers du cœur est principalement d’ordre respiratoire ; tachypnée persistante, toux intermittente combinée à un effort expiratoire. Pour ces raisons, tout chat souffrant d’un syndrome clinique pouvant être suggestif d’asthme félin devrait être évalué pour la possibilité d’une infection aux vers du cœur (Heartworm-associated respiratory disease; HARD), surtout si cet animal a accès à l’extérieur. Malheureusement, avec les tests diagnostiques actuellement disponibles, il n’est pas toujours possible d’établir un diagnostic de façon confiante.
Tests antigéniques : plusieurs inconvénients
Contrairement au chien, la charge parasitaire chez le chat est habituellement très faible et souvent unisexe. Pour cette raison, la présence de microfilaires est habituellement de faible à nulle chez cette race. Les techniques utilisant des méthodes de concentration pour la détection de microfilaires, tel que le modified knot test ou les filtres milipores, demeurent très peu sensibles du point de vue diagnostique.
Les tests antigéniques, aujourd’hui considérés comme la norme diagnostique chez le chien, présentent aussi plusieurs inconvénients chez le chat. Ces tests peuvent détecter la présence d’un seul ver adulte femelle, mais les infections félines peuvent être associées à la présence uniquement de vers mâles. Une étude américaine effectuée sur des nécropsies de chats de refuge a d’ailleurs révélé que 30 à 50 % des chats infectés à D.immitis avaient une infection associée uniquement à la présence de vers mâles.
Une infection récente (présence de vers immatures) ou la présence de complexes antigène-anticorps pouvant interférer avec le test antigénique sont aussi d’autres explications pour la faible sensibilité des tests antigéniques chez le chat.
Il est d’ailleurs préférable de dire d’un test antigénique négatif chez le chat qu’il ne démontre pas la présence d’antigène détectable. Les tests détectant les anticorps félins contre D.immitis sont préférables comme outil diagnostique, vu leur plus grande sensibilité (moins de faux négatifs). Les vers mâles et femelles même immatures (aussi tôt que deux mois) ont la capacité de stimuler la production d’anticorps. Ce test est aussi préférable pour la détection d’infections félines, car des changements histologiques pulmonaires sont notés sur les chats infectés uniquement par des vers au stade larvaire.
Cependant, ce test ne nous permet pas de différencier entre une infection active ou passée. Certains changements radiographiques (élargissement artériel) ou échocardiographiques (présence de vers adultes) peuvent augmenter l’index de suspicion d’une infection féline aux vers du cœur (voir tableau 1).
Traitement
Contrairement au chien, les traitements d’adulticides sont peu recommandés et plutôt utilisés en dernier recours. Étant donné que les signes cliniques chez le chat sont surtout secondaires à la réaction inflammatoire faisant suite à la mort des vers adultes, et non à la charge parasitaire elle-même, il existe peu davantage au traitement adulticide. La mélarsomine étant considérée comme potentiellement toxique chez le chat, lorsqu’un traitement aux adulticides est préconisé, de l’ivermectin est surtout utilisé. Une solution de rechange aux adulticides, lorsque jugée nécessaire, est l’extraction parasitaire chirurgicale.
Si l’animal ne démontre pas de signes cliniques respiratoires, un suivi physique, sérologique et radiographique peut seulement être recommandé aux 3 à 12 mois. Étant donné la durée de vie plus courte (2 à 3 ans) de D.immitis chez le chat, la charge parasitaire habituellement faible et la rareté de microfilaires en circulation, il peut être préférable de laisser la maladie suivre son cours chez le patient asymptomatique. Autrement, les signes cliniques sont principalement gérés à l’aide de prednisolone à dose décroissante. Certains patients peuvent nécessiter des soins intensifs si une réaction anaphylactique (traitement de choc, oxygénothérapie, bronchodilatateur…) importante se manifeste.
Les anti-inflammatoires non stéroïdiens ainsi que l’aspirine ne semblent pas apporter de bénéfices aux patients félins souffrant de dirofilariose, et pourraient même exacerber les lésions au parenchyme pulmonaire.
Traitement préventif
Malgré une population féline au Québec vivant en grande majorité exclusivement à l’intérieur, un traitement préventif pendant les mois à risque, ou à l’année peut être recommandé. Selon une étude rétrospective, 25 % des chats ayant été infectés par le ver du cœur n’avaient pas d’accessibilité à l’extérieur. L’utilisation d’une chémoprophylaxie pour les vers du cœur chez le chat n’est pas tributaire des résultats sérologiques.
En conclusion, les infections aux vers du cœur, même si elles sont rares, sont toutefois possibles chez le chat au Québec. Ces félins ne sont pas toujours cliniquement affectés, mais un chat présentant des signes cliniques respiratoires compatibles devrait être évalué par la possibilité d’une dirofilariose. Le test de dépistage préconisé est le dosage des anticorps contre D.immitis. Un traitement est recommandé lorsque l’animal présente des signes cliniques, et se résume principalement à l’utilisation de corticoïdes. Malgré une population qui peut sembler à première vue à faible risque, un traitement préventif peut quand même être préconisé.
Pour plus d’information sur les infections félines à D.immitis, veuillez consulter le site suivant : American heartworm society
Pour télécharger le Focus du 14 mai 2014, cliquez ici.
Afin d’améliorer nos outils diagnostiques dans le domaine de l’imagerie médicale, le Centre DMV s’est récemment doté d’un tout nouveau CT-scan. Des examens de tomodensitométrie étaient déjà disponibles depuis quelques années au Centre par l’entremise de notre ancienne machine, mais nous restions limités dans les types d’examens disponibles.
Notre nouveau bébé, un Toshiba Aquilion 16, nous permet maintenant de faire l’acquisition combinée de plusieurs coupes anatomiques à chaque rotation du tube radiographique. Ceci réduit considérablement le temps d’acquisition (jusqu’à un facteur de 16) et permet d’obtenir des coupes anatomiques beaucoup plus minces qu’auparavant.
Examens sous sédation
Plusieurs avantages découlent de la diminution du temps d’examen. Le plus probant est certainement la possibilité d’effectuer maintenant la plupart de nos examens sur des patients sous sédation plutôt que sous anesthésie générale. Ceci permet donc à la fois de limiter les coûts pour le client et d’agrandir le spectre des patients qui peuvent subir cet examen.
Des patients instables pour qui une anesthésie générale pourrait être dangereuse peuvent maintenant profiter de l’apport diagnostic du CT-scan s’ils sont à même de supporter une sédation profonde.
De plus, un petit ajout à notre matériel de contention, le VetMouse TrapTM, est maintenant disponible pour effectuer certains examens de chats instables sans même devoir administrer de sédation. Il s’agit d’un cylindre de plastique vide qui peut tout juste contenir l’animal dans une position confortable et stable, avec un orifice d’apport d’oxygène enrichi au besoin.
Des examens plus spécifiques
La gamme d’examens disponibles avec notre nouvelle machine s’est aussi élargie : nous pouvons maintenant effectuer des examens plus spécifiques de certaines régions ou de certaines pathologies.
Les hernies discales restent actuellement les pathologies les plus visées par nos examens. Cavités nasales, bulles tympaniques, thorax pour recherche de métastases ou autres pathologies thoraciques, abdomen de très gros chien, lipomes infiltrants, examens myoarthrosquelettiques divers, sont aussi toujours au menu. La version 2.0 de ces examens trouve toutefois son avantage dans l’acquisition de coupes plus fines et donc plus précises.
La qualité des examens de contraste est aussi de beaucoup améliorée.
Parmi les nouveaux examens qui peuvent maintenant être effectués, on doit compter les recherches de shunts porto systémiques, les examens de fractures complexes, les bilans d’extensions complets (whole body scan) pour les patients accidentés ou cancéreux, et même l’imagerie de base du cerveau sur les patients instables (recherche d’une hémorragie intracrânienne par exemple).
Évaluation préalable
Si un vétérinaire référant désire nous envoyer un patient pour obtenir un CT-scan, les propriétaires doivent être mis au courant que d’autres tests ou traitements pourraient aussi devenir nécessaires, selon les résultats obtenus lors de l’examen. C’est dans cette optique que les références pour CT-scan doivent être effectuées par l’entremise d’un département autre que celui d’imagerie.
Qu’il s’agisse du département de médecine interne, de neurologie, de l’urgence ou tout autre département du Centre, le futur « scanné » sera évalué par ce département puis le CT-scan pourra par la suite être effectué en collaboration avec le département d’imagerie.
Les radiologistes du Centre ainsi que leur équipe restent évidemment disponibles pour répondre aux questions des vétérinaires pour d’éventuelles références de cas pour CT-Scan. Ne vous gênez pas pour vous renseigner sur notre petit nouveau… nous en sommes si fier !
Dr Hugo Joly, DMV, Radiologiste (DACVR)
Dans ce numéro, Dre Helaine Haltrecht explique comment l’acupuncture et des suppléments naturels peuvent régler un problème de diarrhée chronique.
Pour télécharger l’article, cliquez ici.
Ce numéro du Focus DMV propose un article sur la luxation médiale de la rotule chez le chien. L’article explique en détail les symptômes, les causes et les traitements et pronostic pour cette condition médicale.
Pour télécharger ce numéro, cliquez ici.